想看懂《我不是药神》,你需要了解的药品行业规定之二:仿制药注册
电影《我不是药神》上映后,许多影评中都提到为什么需要到印度才能购买到低价的瑞士“格列宁”仿制药,而中国没有企业生产该仿制药。在上一篇文章的结尾,我们提到,根据中国的相关规定,原研药专利期满前2年,申请人就可以申请原研药的仿制药注册。这并不意味着在原研药的专利期满后,中国的患者就可以马上吃上国产的仿制药。中国的仿制药注册必须要满足SDA的一系列要求,审批时限也较为漫长。中国为了加快仿制药上市的速度,也进行了一系列的改革。本文将介绍仿制药注册的相关规定及主要政策的变化。
一、什么是仿制药
简单来说,仿制药是指在原研药上市并超过专利保护期后,在化学结构上一致的仿制品。根据中国的相关规定,仿制药上市需要注册。
二、仿制药注册
由于生物类似药(即生物制品的仿制药)按照新药的流程注册,本文所称仿制药注册仅包括中药天然药物和化学药品,不包括生物类似药的注册。

(一) 中药、天然药物和化学药品注册的分类
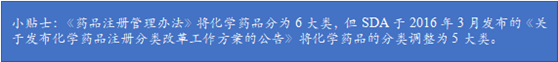
根据《药品注册管理办法》和相关规定,中药、天然药物的注册分类的第9类和化学药品新注册分类的第3类和第4类按照仿制药的程序申报。
(二) 注册流程
1、临床试验
并不是所有的仿制药都需要进行临床试验,即使进行临床试验的仿制药,也不需要像新药一样在申报前必须完成I、II、III期临床试验。根据《药品注册管理办法》,对于中药、天然药物的仿制药,视情况需要,进行不少于100对的临床试验;对于化学药品,《化学药品新注册分类申报资料要求(试行)》对3类和4类药品的临床试验作出了相应的要求。
2、仿制药注册
《药品注册管理办法》对仿制药的注册流程进行了规定,但SDA于2017年11月发布的《关于调整药品注册受理工作的公告》将注册的流程进行了调整。2017年12月1日后,凡依据现行法律、法规和规章由SDA审评审批、备案的注册申请均由SDA受理,由省级药监部门审批、备案的药品注册申请仍由省级药监部门受理。

此外,根据《关于调整药品注册受理工作的公告》,对于化学类的仿制药,受理后CDE对化学药品仿制药申报资料进行立卷审查,符合要求的,于45个工作日内完成立卷;不符合要求的,不予批准,并说明理由。

除了SDA发布的规定外,CDE也于2017年11月发布了《关于药品注册集中受理有关事项的通知》,对于SDA《关于调整药品注册受理工作的公告》所规定的事项进行了细化,并发布了各类药品的申报资料指南作为该通知的附件。
3、注册程序的暂停
《药品注册管理办法》规定,已确认存在安全性问题的上市药品,SDA可以决定暂停受理和审批其仿制药申请。
三、仿制药的疗效
仿制药仅复制原研药的主要分子结构,并且在上市前不需要完成3期临床试验,其优点在于企业能够省时、省资、省力。但是,由于仿制药其余成分的添加和制造工艺可能不会与原研药相同,仿制药的疗效可能不会原研发药完全相同。但这并不代表仿制药就是电影中瑞士格列宁代表所称的假药。中国也一直在致力于提高仿制药的质量标准。
2007年发布的《药品注册管理办法》要求,仿制药应当与被仿制药具有同样的活性成份、给药途径、剂型、规格和相同的治疗作用。已有多家企业生产的品种,应当参照有关技术指导原则选择被仿制药进行对照研究。
SDA于2015年11发布的《关于药品注册审评审批若干政策的公告》要求提高仿制药审批标准,并规定仿制药按与原研药质量和疗效一致的原则受理和审评审批。其中,对已在中国境外上市但尚未在境内上市药品的仿制药注册申请,应与原研药进行生物等效性研究并按国际通行技术要求开展临床试验,未能与原研药进行对比研究的,应按照创新药的技术要求开展研究。该公告对已经受理的仿制药注册申请,实行分类处理:
(1) 中国境内已有批准上市原研药,申请注册的仿制药没有达到与原研药质量和疗效一致的,不予批准。
(2) 中国境外已上市但境内没有批准上市原研药,申请仿制药注册的企业可以选择按原规定进行审评审批,但在药品批准上市3年内需按照国发〔2015〕44号文件规定进行质量和疗效一致性评价,未通过一致性评价的注销药品批准文号;企业也可以选择撤回已申报的注册申请,改按与原研药质量和疗效一致的标准完善后重新申报。对上述重新申报的注册申请实行优先审评审批,批准上市后免于进行质量和疗效一致性评价。

四、仿制药一致性评价
1、 什么是仿制药的一致性评价
2012年1月国务院发布的《国家药品安全“十二五”规划》中首次提出仿制药一致性评价的概念。2016年2月国务院下发了《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号,下称8号文),仿制药的一致性评价的工作正式全面展开。此后,国务院、SDA和CDE又下发了一系列关于仿制药一致性评价的规定和技术指南,对仿制药一致性评价进行了更加详细的规定和指导。
根据8号文,化学药品新注册分类实施前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价。国家基本药物目录(2012年版)中2007年10月1日前批准上市的化学药品仿制药口服固体制剂,应在2018年底前完成一致性评价,其中需开展临床有效性试验和存在特殊情形的品种,应在2021年底前完成一致性评价。

2、 通过后的优惠政策
根据8号文,通过一致性评价的药品品种,在医保支付方面予以适当支持,医疗机构应优先采购并在临床中优先选用。同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种。
3、 未通过的后果
根据8号文,化学药品新注册分类实施前批准上市的其他仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价;逾期未完成的,不予再注册。
五、小结
再回到电影中来,正是由于人们发现作为仿制药的印度格列宁的疗效与瑞士格列宁的疗效基本一致,印度格列宁才开始在慢粒白血病的患者中大量的流通。但不论是男主角以QQ群的方式将药品提供给患者,还是像电影中的假药贩子一样通过会议营销的方式将药品销售给患者,除了触犯了刑罚,都是不符合药品流通环节的管理规定。下一篇文章我们将介绍药品流通环节的相关规定。
本文仅为我们对相关法律、法规及政策的一般解读,不能作为正式的法律意见和建议,如果您有特定的问题,请与观韬中茂律师事务所联系咨询事宜。
作者简介:王元哲律师,观韬中茂国际公司证券业务组律师。
王 元 哲
律 师
观韬中茂北京办公室
电 话:+8610 6657 8066
传 真:+8610 6657 8016
电子邮箱:wangyzh@guantao.com